CIENCIAS - SECUNDARIA 3
¿Cómo represento y explico la formación de compuestos iónicos y moleculares?
(JUEVES 04 FEBRERO)
ACTIVIDAD:Es importante que sigas aprendiendo y comiences la preparación para tu examen COMIPEMS, por ello, te sugerimos visitar los sitios de internet, donde podrás reforzar tus conocimientos sobre los enlaces químicos además de poner a prueba tus habilidades realizando los ejercicios que ahí te proponen.
http://uapas2.bunam.unam.mx/ciencias/enlaces_quimicos/
https://portalacademico.cch.unam.mx/alumno/quimica1/unidad2/tiposdeenlaces
http://objetos.unam.mx/quimica/enlaceIonico/index.html
RESUMEN:
Observa con atención el siguiente video de minuto 5:14 a 6:09 y reflexiona ¿qué semejanzas y diferencias existen entre el modelo de Bohr y el diagrama de Lewis?
- Cómo se forman las moléculas
Cómo pudiste identificar, el diagrama de Lewis es una representación gráfica que muestra los enlaces entre los átomos de una molécula, que se pueden formar cuando los átomos comparten electrones.
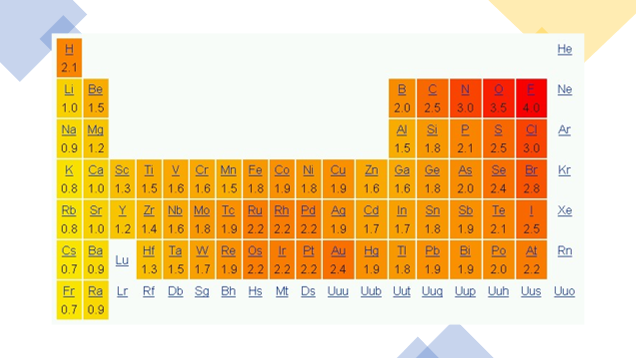
Recuerda, la electronegatividad se puede definir de manera sencilla como la capacidad de un elemento para atraer hacia él los electrones que forman enlaces en un compuesto químico. Esta propiedad periódica permite predecir la polaridad del enlace formado entre dos átomos, es decir, nos permite identificar si en un enlace químico existe una distribución asimétrica de los electrones.
La electronegatividad está estrechamente relacionada con la energía de ionización y la afinidad electrónica, conceptos abordados en sesiones anteriores. Un átomo con una afinidad electrónica alta y un potencial de ionización elevado presenta una electronegatividad alta, por ejemplo, el cloro o el flúor, al contrario, átomos con baja afinidad electrónica y bajo potencial de ionización tienen electronegatividad pequeña como el litio o el sodio.
La electronegatividad aumenta hacia la derecha y hacia arriba en la tabla periódica, como se muestra en la imagen.
Como dato curioso. El metano es un gas inodoro y sin color, y además es muy poco soluble en agua. El 51% de su producción es debido a la ganadería, y solo el 13% a los medios de trasporte.
El metano puede ser empleado como combustible doméstico (para cocinar, calentar agua; incluso, para generar electricidad), aunque se considera que acelera el calentamiento global.

http://ciencia.unam.mx/uploads/textos/nt_cambioclimaticonature_21112013.jpg
Para el primer ejemplo de un compuesto iónico se tomará el cloruro de sodio, se comenzará con los elementos que forman este compuesto, para esto observa con atención el video de una aplicación de realidad aumentada.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 2
Ahora, realiza el diagrama de Lewis para observar la manera en que interactúan estos átomos para la formación del cloruro de sodio.
Observa la ecuación de la reacción química, coloca los coeficientes necesarios para que cumpla con la ley de la conservación de la materia y comprueba qué tanto hay en reactivos como en productos, de manera que el número total de átomos de cada elemento sea el mismo.
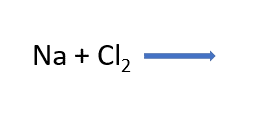

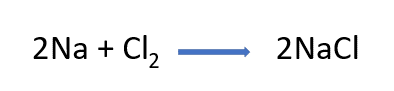
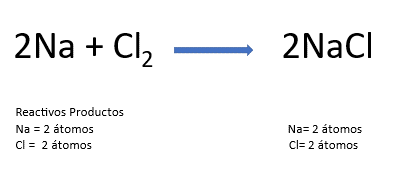
Después realiza la diferencia de electronegatividades,

de acuerdo con la tabla vista anteriormente y los valores de referencia para cada tipo de enlace.

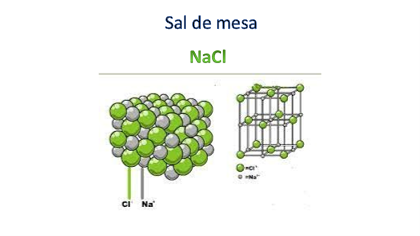
Finalmente, recuerda que, aunque simplificas la formación de un compuesto iónico con la ecuación química, en realidad se forman redes unidas por la atracción electrostática entre los átomos.
Para el siguiente ejemplo de un compuesto molecular, toma el metano, un gas que se encuentra normalmente en la atmósfera en bajas concentraciones pero que ha ido en aumento por la actividad ganadera. Comienza con los elementos que forman este compuesto, para esto observa con atención el video.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 3
Ahora realiza el diagrama de Lewis para observar la manera en que interactúan estos átomos en la formación del compuesto.
Observa con atención la formación de la molécula de metano en el siguiente video:
- Q3_B3_PG2_F1_SEM21_100121 Anexo 4
Observa el siguiente video con el modelo en 3D de la molécula de metano, donde se aprecian los valores de los ángulos entre átomos y la geometría de la molécula.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 5
Observa la ecuación de la reacción química para la formación del metano, coloca los coeficientes necesarios para que cumpla con la ley de la conservación de la materia y comprobamos qué tanto hay en reactivos como en productos, de manera que, el número total de átomos de cada elemento sea el mismo.
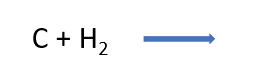
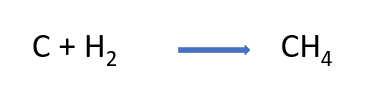
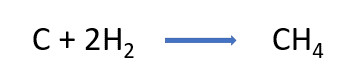
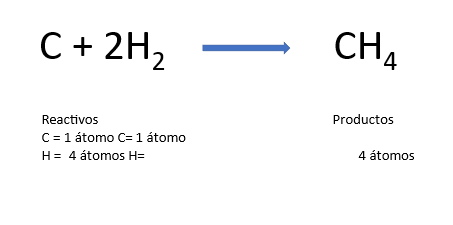
Finalmente, analiza la diferencia de electronegatividades

de los elementos de acuerdo con la tabla vista anteriormente, y los valores de referencia para cada tipo de enlace.

Estos ejemplos han integrado los modelos y las representaciones de átomos y moléculas vistos hasta ahora, realiza los mismos pasos de los ejemplos que se te presentaron con un par de compuestos muy sencillos: el agua y el dióxido de carbono.
Realízalo en tu libreta de la asignatura, recuerda que es tu bitácora científica.
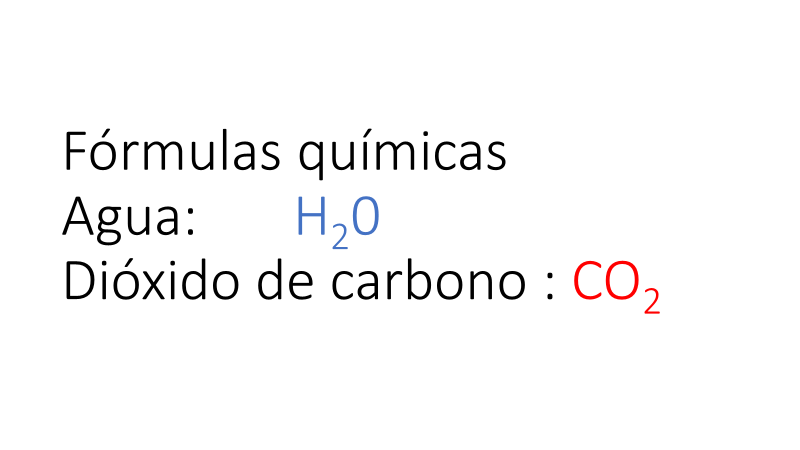
Recuerda su fórmula y sigue los mismos pasos:
- Identifica los elementos que forman al compuesto.
- Realiza el modelo de Bohr con su respectivo número de protones, neutrones y electrones.
- Elabora el diagrama de Lewis, con puntos y cruces, y recuerda completar la regla del octeto.
- Investiga la forma de la molécula y el ángulo entre los átomos.
- Elabora la ecuación química y asegúrate que cumpla con la ley de conservación de la materia colocando los coeficientes necesarios.
- Realiza la diferencia de los valores de electronegatividad.
- Finalmente, identifica el tipo de enlace de acuerdo con los valores de referencia presentados.

https://alianzasalud.org.mx/wp-content/uploads/2015/03/reduce-tu-consumo-d-sal.jpg
Como ya identificaste, el cloruro de sodio (NaCl) es un compuesto iónico, y comúnmente es conocido como sal. Forma parte imprescindible de la dieta, sin embargo, los mexicanos consumen alrededor de 4 mil 400 miligramos (mg) de sodio (11 gramos de sal), es decir, más del doble de lo recomendado por la Organización Mundial de la Salud (OMS), quien sugiere 2 mil mg de sodio (5 gramos de sal) al día.
La mayor parte del sodio en la dieta proviene de alimentos y bebidas procesadas.
¿Por qué es importante reducir el consumo de sodio?
Al hacerlo, evitarás que tu cuerpo retenga agua, y puede ayudarte a prevenir enfermedades como la hipertensión, problemas cardiovasculares, enfermedad renal y osteoporosis.
Es importante que sigas aprendiendo y comiences la preparación para tu examen COMIPEMS, por ello, te sugerimos visitar los sitios de internet, donde podrás reforzar tus conocimientos sobre los enlaces químicos además de poner a prueba tus habilidades realizando los ejercicios que ahí te proponen.
http://uapas2.bunam.unam.mx/ciencias/enlaces_quimicos/
https://portalacademico.cch.unam.mx/alumno/quimica1/unidad2/tiposdeenlaces
http://objetos.unam.mx/quimica/enlaceIonico/index.html
Observa con atención el siguiente video de minuto 5:14 a 6:09 y reflexiona ¿qué semejanzas y diferencias existen entre el modelo de Bohr y el diagrama de Lewis?
- Cómo se forman las moléculas
Cómo pudiste identificar, el diagrama de Lewis es una representación gráfica que muestra los enlaces entre los átomos de una molécula, que se pueden formar cuando los átomos comparten electrones.
Recuerda, la electronegatividad se puede definir de manera sencilla como la capacidad de un elemento para atraer hacia él los electrones que forman enlaces en un compuesto químico. Esta propiedad periódica permite predecir la polaridad del enlace formado entre dos átomos, es decir, nos permite identificar si en un enlace químico existe una distribución asimétrica de los electrones.
La electronegatividad está estrechamente relacionada con la energía de ionización y la afinidad electrónica, conceptos abordados en sesiones anteriores. Un átomo con una afinidad electrónica alta y un potencial de ionización elevado presenta una electronegatividad alta, por ejemplo, el cloro o el flúor, al contrario, átomos con baja afinidad electrónica y bajo potencial de ionización tienen electronegatividad pequeña como el litio o el sodio.
La electronegatividad aumenta hacia la derecha y hacia arriba en la tabla periódica, como se muestra en la imagen.

Como dato curioso. El metano es un gas inodoro y sin color, y además es muy poco soluble en agua. El 51% de su producción es debido a la ganadería, y solo el 13% a los medios de trasporte.
El metano puede ser empleado como combustible doméstico (para cocinar, calentar agua; incluso, para generar electricidad), aunque se considera que acelera el calentamiento global.

http://ciencia.unam.mx/uploads/textos/nt_cambioclimaticonature_21112013.jpg
Para el primer ejemplo de un compuesto iónico se tomará el cloruro de sodio, se comenzará con los elementos que forman este compuesto, para esto observa con atención el video de una aplicación de realidad aumentada.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 2
Ahora, realiza el diagrama de Lewis para observar la manera en que interactúan estos átomos para la formación del cloruro de sodio.
Observa la ecuación de la reacción química, coloca los coeficientes necesarios para que cumpla con la ley de la conservación de la materia y comprueba qué tanto hay en reactivos como en productos, de manera que el número total de átomos de cada elemento sea el mismo.

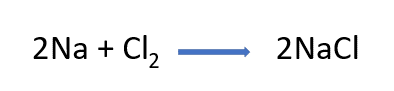
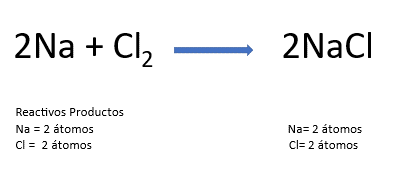
Después realiza la diferencia de electronegatividades,

de acuerdo con la tabla vista anteriormente y los valores de referencia para cada tipo de enlace.


Finalmente, recuerda que, aunque simplificas la formación de un compuesto iónico con la ecuación química, en realidad se forman redes unidas por la atracción electrostática entre los átomos.
Para el siguiente ejemplo de un compuesto molecular, toma el metano, un gas que se encuentra normalmente en la atmósfera en bajas concentraciones pero que ha ido en aumento por la actividad ganadera. Comienza con los elementos que forman este compuesto, para esto observa con atención el video.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 3
Ahora realiza el diagrama de Lewis para observar la manera en que interactúan estos átomos en la formación del compuesto.
Observa con atención la formación de la molécula de metano en el siguiente video:
- Q3_B3_PG2_F1_SEM21_100121 Anexo 4
Observa el siguiente video con el modelo en 3D de la molécula de metano, donde se aprecian los valores de los ángulos entre átomos y la geometría de la molécula.
- Q3_B3_PG2_F1_SEM21_100121 Anexo 5
Observa la ecuación de la reacción química para la formación del metano, coloca los coeficientes necesarios para que cumpla con la ley de la conservación de la materia y comprobamos qué tanto hay en reactivos como en productos, de manera que, el número total de átomos de cada elemento sea el mismo.
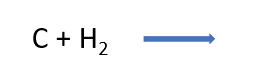
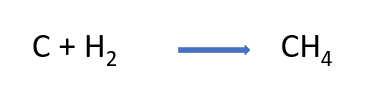
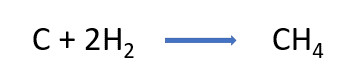

Finalmente, analiza la diferencia de electronegatividades

de los elementos de acuerdo con la tabla vista anteriormente, y los valores de referencia para cada tipo de enlace.

Estos ejemplos han integrado los modelos y las representaciones de átomos y moléculas vistos hasta ahora, realiza los mismos pasos de los ejemplos que se te presentaron con un par de compuestos muy sencillos: el agua y el dióxido de carbono.
Realízalo en tu libreta de la asignatura, recuerda que es tu bitácora científica.

Recuerda su fórmula y sigue los mismos pasos:
- Identifica los elementos que forman al compuesto.
- Realiza el modelo de Bohr con su respectivo número de protones, neutrones y electrones.
- Elabora el diagrama de Lewis, con puntos y cruces, y recuerda completar la regla del octeto.
- Investiga la forma de la molécula y el ángulo entre los átomos.
- Elabora la ecuación química y asegúrate que cumpla con la ley de conservación de la materia colocando los coeficientes necesarios.
- Realiza la diferencia de los valores de electronegatividad.
- Finalmente, identifica el tipo de enlace de acuerdo con los valores de referencia presentados.

https://alianzasalud.org.mx/wp-content/uploads/2015/03/reduce-tu-consumo-d-sal.jpg
Como ya identificaste, el cloruro de sodio (NaCl) es un compuesto iónico, y comúnmente es conocido como sal. Forma parte imprescindible de la dieta, sin embargo, los mexicanos consumen alrededor de 4 mil 400 miligramos (mg) de sodio (11 gramos de sal), es decir, más del doble de lo recomendado por la Organización Mundial de la Salud (OMS), quien sugiere 2 mil mg de sodio (5 gramos de sal) al día.
La mayor parte del sodio en la dieta proviene de alimentos y bebidas procesadas.
¿Por qué es importante reducir el consumo de sodio?
Al hacerlo, evitarás que tu cuerpo retenga agua, y puede ayudarte a prevenir enfermedades como la hipertensión, problemas cardiovasculares, enfermedad renal y osteoporosis.
No hay comentarios.:
Publicar un comentario